En el presente artículo hablaremos del nilotinib, que es un medicamento que se utiliza en el tratamiento de los casos de leucemia en adultos, también hablaremos de cómo actúa, sus indicaciones, contraindicaciones, advertencias, interacciones, toxicidad y algo más.
Nilotinib ¿qué es?
El nilotinib es cohibidor potente de la acción de la tirosina kinasa Abl de la oncoproteína Bcr-Abl, tanto en las líneas celulares como en las células leucémicas primarias del cromosoma Filadelfia positivo. Se usa para la terapia de los pacientes adultos que padecen leucemia mieloide crónica (LMC) cromosoma Filadelfia positivo en fase crónica y en fase acelerada, y que presentan intolerancia a una terapia anterior.
El nilotinib es un tratamiento dirigido. Este medicamento está clasificado como un cohibidor de la transducción de señales – cohibidor de la proteína tirosina quinasa.
Cómo actúa el nilotinib
La terapia dirigida ha sido el resultado de estudios realizados por más de cien años, que se han dedicado a tratar de entender las comparaciones que existen entre las células normales y la células cancerosas. Actualmente, la terapia para el cáncer se ha centrado de manera principal en destrucción de las células que se dividen de forma rápida, por ser ésta una de las característica de las células cancerosas.
Pero desafortunadamente, existen algunas células normales (sanas) también se dividen de forma rápida; por lo que se presentan distintos efectos secundarios.
La terapia dirigida se trata de señalar cuales son las células cancerosas. Los científicos están buscado las comparaciones más específicas entre las células cancerosas y las células sanas.
Toda esta información se usa para elaborar una terapia dirigida que ataque solamente las células cancerosas sin causar daño las células sanas, y de esta forma se presenten menor cantidad de efectos no deseados.
Cada clase de terapia dirigida trabaja de forma distinta, pero todas tienen interferencia con la capacidad de las células cancerosas con respecto a su crecimiento, su división, su reparación y/o comunicación con otras células.
Hay varias clases de terapias dirigidas, que se encuentran definidas en tres categorías amplias. Algunas de estas terapias dirigidas se concentran en los elementos internos y en el funcionamiento de la célula cancerosa. Las terapias dirigidas usan moléculas muy pequeñas, que se pueden llegar a introducir en la célula y de esta forma afectar su funcionamiento, ocasionando su muerte.
Existen una variedad de terapias dirigidas que se concentran en las partes internas de las células. En cambio otras terapias dirigidas se encuentran o tienen el fin de dirigirse a los receptores que están se ubican en la parte externa de la célula. Las terapias dirigidas a los receptores también son conocidas como anticuerpos monoclonales. Los cohibidores antiangiogénicos se concentran en los vasos sanguíneos que aportan el oxígeno a las células, causando finalmente que las células no tengan nutrición.
El nilotinib forma parte de la categoría de terapias dirigidas de cohibidores de la transducción de señales. Particularmente, es un cohibidor de la proteína tirosina quinasa y va dirigido a la quinasa del BCR-ABl, al c-KIT y al receptor del factor de crecimiento derivado de plaquetas (por sus siglas en inglés PDGFR).
En la actualidad se continúan con las investigaciones para poder identificar qué tipos de cáncer pueden ser tratados mejor con terapias dirigidas, y para poder identificar los objetivos adicionales para más clases de cáncer.
¿Qué es la leucemia?
La leucemia es el nombre que reciben un grupo de trastornos malignos de la médula ósea (el cáncer hematológico) que causa un incremento descontrolado de leucocitos de la médula ósea.
Pero en algunas clases de leucemias también se pueden llegar a afectar cualquiera de los precursores de las distintas líneas celulares de la médula ósea, como son los precursores mieloides, monocíticos, eritroides o megacariocíticos. Las células cancerígenas bloquean la producción de los glóbulos rojos, las plaquetas y de los glóbulos blancos maduros (leucocitos) sanos.
Por lo que se pueden llegar a presentar algunos síntomas que pueden ser potencialmente mortales, a medida que se reducen las cantidades de células sanguíneas sanas. Las células cancerosas se pueden llegar a propagar a la corriente sanguínea y a los ganglios linfáticos. También puede llegar a viajar hasta el cerebro y a la médula espinal (el sistema nervioso central) y a otras zonas del organismo. (Ver artículo progesterona)
La leucemia es una clase de cáncer de la sangre que tiene su inicio en la médula ósea, que es el tejido blando que se ubica en la parte media de los huesos, lugar donde se elaboran las células sanguíneas.
La palabra leucemia significa sangre blanca. Los glóbulos blancos (llamados también leucocitos) son elaborados en la médula ósea y el organismo los usa para luchar contra infecciones y otro tipo de sustancias desconocidas.
La leucemia lleva a un incremento desmesurado de la cantidad de glóbulos blancos.
La leucemia puede llegar a afectar tanto a niños y como a adultos.
Las leucemias se dividen en dos tipos primordialmente:
-La aguda (que es la que progresa muy rápidamente): Leucemia linfocítica aguda (LLA); Leucemia mielógena aguda (LMA).
-La crónica (que es la que progresa más lentamente): Leucemia linfocítica crónica (LLC); Leucemia mielógena crónica (LMC); Leucemia de células pilosas.
Nombre comercial
El nombre comercial del nilotinib es: Tasigna que viene en cápsulas duras de 200 mg.
Mecanismo de acción
La translocación entre una parte del cromosoma 9 y una parte del cromosoma 22, que genera un gen con defectos que expresa la oncoproteína Bcr-Abl; se llama así por que el gen que la genera procede de parte gen de región de fractura (BCR, Breakpoint Cluster Region) del cromosoma 22 (que se encuentra situado en la región q11 de este gen) que se fusiona con una parte del gen ABL del cromosoma 9 (que se encuentra situado en la región q34).
La proteína Brc-Abl tiene acción tirosina kinasa, esto quiere decir que tiene la capacidad de agregar grupos fosfatados a la tirosina, y que tiene la capacidad de activar una serie de mensajeros que provocan la proliferación celular.
El nilotinib se une con mucha afinidad al lugar de unión del ATP, de tal forma que es un potente cohibidor de la acción tirosina-kinasa del Bcr-Abl de tipo germinal. Por otro lado, este medicamento logra mantener su acción frente a 32/33 formas mutantes de Bcr-Abl que son resistentes al imatinib.
Como un efecto adverso de esta acción bioquímica, nilotinib cohíbe de manera selectiva la proliferación y provoca la apoptosis en líneas celulares y en células leucémicas primarias cromosoma Filadelfia positivo, de los pacientes con que tienen leucemia mielógena crónica (LMC).
El nilotinib no llega a afectar a la gran mayoría de las protein-kinasas exceptuando las kinasas de los receptores a PDGF, KIT-c y Ephin, enzimas que son cohibidas dentro del rango de cantidades que se logran alcanzar posteriormente de una dosis terapéutica.
Farmacocinética
Posteriormente a la dosis oral, el nilotinib llega a alcanzar una cantidades máximas en sangre en un tiempo de tres (3) horas después de la aplicación. La absorción es del 30% aproximadamente incrementadose entre un 15% y un 30% cuando se consume de forma inmediata después de la ingesta de algunos alimentos. El nilotinib se adhiere de manera extensa a las proteínas plasmáticas (98%). La farmacocinética del nilotinib es lineal, presentando los niveles plasmáticos de forma proporcional a las terapias que se encuentran en un índice de 400 a 800 mg/día.
El nilotinib es metabolizado en el hígado a por medio de la isoenzima CYP3A4, provocando metabolitos hidroxilados y oxidados inactivos. Después de una dosis única de nilotinib marcado con carbono-14 en personas voluntarias sanas, más del 90% de la dosis se llegó a eliminar dentro de los siete (7) siguientes, de manera principal por las heces (94% de la dosis) que corresponde a el 69% de la dosis al nilotinib intacta. (Ver artículo tiamazol)
Indicaciones
El nilotinib es un medicamento que está indicado para:
-Para el tratamiento de los pacientes adultos que padecen leucemia mieloide crónica cromosoma Filadelfia positivo (LMC Ph+) que tienen o que fueron diagnosticados en fase crónica (FC) por poco tiempo.
-Para el tratamiento de los pacientes adultos que padecen la leucemia mieloide crónica cromosoma Filadelfia positivo (LMC Ph+) en frase crónica (FC) ,y en fase acelerada (FA) que presentan resistencia o intolerancia a al menos un (1) tratamiento anterior, inclusive el tratamiento con el imatinib.
Dosis
–Para tratar a los de pacientes adultos que padecen leucemia mieloide crónica (LMC) cromosoma Filadelfia positivo en fase crónica y en fase acelerada, con resistencia o intolerancia a una terapia previa, inclusive con el imatinib:
Aplicación oral:
Para los adultos: la dosis que se recomienda es de 400 mg dos (2) veces por día. La terapia se debe prolongar mientras se presente el beneficio para el paciente.
El nilotinib se puede llegar a aplicar en conjunto con factores de crecimiento hematopoyético como la eritropoyetina o de el factor estimulante de colonias de granulocitos (G-CSF), o con la hidroxiurea o la anagrelida si se encuentra indicado.
La aplicación del nilotinib se debe realizar por lo menos dos (2) horas porteriormente a la ingesta de los alimentos.
La terapia debe estar indicada por un médico especialista en el diagnóstico y en el tratamiento de los pacientes con leucemia mieloide crónica (LMC).
Para los niños : hasta el momento no se conocen datos de la seguridad y de la eficiencia del nilotinib en niños y en los adolescentes de menos de dieciocho (18) años de edad.
Para los pacientes que sufren deficiencia hepática: el nilotinib se metaboliza en el hígado, por lo que la deficiencia hepática presenta un efecto relativamente suave en la farmacocinética de nilotinib. Aunque no se requiere el realizar un ajuste de las dosis, los pacientes que sufren deficiencia hepática deben ser tratados con mucha precaución.
Contraindicaciones
El nilotinib se encuentra contraindicado para los pacientes que presentan algún tipo de alergia o hipersensibilidad al principio activo o a alguno de los componentes de la fórmula.
Se han presentado casos poco frecuentes (0,1 a 1%) de muertes súbitas en los pacientes que se encuentran bajo tratamiento con nilotinib, que tienen antecedentes de afecciones cardíacas o factores de algún tipo de riesgo cardíaco significativo. En la gran mayoría de los casos, también se encuentran presentes co-morbilidades a parte del proceso maligno de base, así como fármacos concomitantes. Los trastornos de la repolarización ventricular pueden llegar a ser factores contributivos.
Advertencias
La terapia con nilotinib está ligada a la trombocitopenia, la neutropenia y a la anemia (Grado 3-4 según el «Common Toxicity Criteria» del National Cancer Institute). Se presenta con mayor frecuencia en los pacientes que sufren leucemia mieloide crónica en fase acelerada. Se deben realizar hemogramas completos por lo menos cada dos (2) semanas durante los primeros dos (2) meses de tratamiento y después cada mes, o con la frecuencia que indique el médico.
Esta mielosupresión usualmente se revierte suprimiendo el consumo de el nilotinib de manera temporal o con una disminución de la dosis. (Ver artículo dexametasona)
Se ha presentado que con el consumo del nilotinib se prolonga la repolarización cardíaca ventricular de manera dependiente de la cantidad, que se mide por el intervalo QT del electrocardiograma. Pero a pesar de eso, no se han presentado torsades de pointes.
Los pacientes que se encuentran bajo la terapia con fármacos que prolongan el intervalo QT, o con la aplicación en conjunto de cohibidores de la CYP3A4, así como también los que tienen hipopotasemia e hipomagnesemia son los más propensos a sufrir este efecto. La prolongación del intervalo QT puede llegar a exponer a los pacientes a un riesgo de tipo mortal.
La deficiencia hepática tiene un efecto de tipo suave sobre la farmacocinética de nilotinib. La aplicación de una dosis única de 200 mg de nilotinib llegó a provocar incrementos del AUC de 35%, 35% y 19% en los pacientes con deficiencia hepática leve, moderada y grave, de forma respectiva, comparados con el grupo control de personas que tienen una función hepática normal.
La Cmax en el estado estacionario de nilotinib (steady state) demostró un incremento de 29%, 18% y 22%, de manera respectiva. Los algunos ensayos clínicos se excluyeron los pacientes que tienen alanino transaminasa (ALT) y/o de aspartato transaminasa (AST) mayor a 2,5 veces o mayor a 5, si se encuentra ligado con la enfermedad al límite superior del intervalo normal y/o bilirrubina total mayor a 1,5 veces al límite superior del intervalo normal.
Toxicidad
En ciertos estudios de toxicidad subaguda (en un tiempo de 4 semanas) realizados en perros y de la toxicidad crónica (en un tiempo de 9 meses) realizado en monos, los descubrimientos bioquímicos de más relevancia incluyeron un incremento de la acción alanina aminotransferasa y fosfatasa alcalina y los descubrimientos histopatológicos fueron primordialmente la hiperplasia/hipertrofia de la célula sinusoidal o célula Kupffer, la hiperplasia del conducto biliar y la fibrosis periportal .
En general los estos cambios bioquímicos fueron reversibles completamente, posteriormente a un periodo de recuperación de cuatro (4) semanas y los trastornos histológicos demostraron una reversibilidad de forma parcial.
Las exposiciones a dosis más bajas a las que se presentaron ciertos efectos sobre el hígado, fueron menos que las de la exposición en los seres humanos a una dosis de 800 mg/día. En los ratones o las ratas que fueron tratadas durante un máximo de veintiséis (26) semanas, solamente se presentaron trastornos hepáticos menores. En las ratas, los perros y los monos se presentó un incremento del nivel de colesterol, que en la mayoría de los casos es reversible.
No se han realizado estudios de carcinogénesis. En la batería estándar de tests de mutagénesis, el nilotinib no demostró ningún tipo de efecto clastogénico.
Aunque el nilotinib no es un fármaco teratogénico, demuestra tener una cierta embrio- fetotoxicidad a dosis que también ocasionan algún tipo de toxicidad a la madre. Se ha presentado un incremento en las pérdidas post implantación en algunos estudios de fertilidad, con la terapia en los machos y en las hembras, y en la investigación de embriotoxicidad, con la terapia de las hembras.
En las investigaciones de embriotoxicidad se presentó letalidad embriológica y ciertos efectos fetales (primordialmente reducción del peso del feto, fusión de manera prematura de los huesos faciales (fusión de los huesos maxilar superior/cigomático) las modificaciones viscerales y las esqueléticas) en las ratas y un incremento de la resorción de los fetos y de alteraciones esqueléticas en los conejos.(Ver artículo cetrorelix)
En un estudio realizado de desarrollo pre y postnatal en las ratas de laboratorio, la exposición materna a nilotinib provocó una disminución del peso corporal de las crías.
Embarazo
Hasta el momento no hay datos sobre el uso del nilotinib en las pacientes que se encuentran embarazadas. Algunos estudios realizados en animales han demostrado la presencia de cierta toxicidad a nivel de la reproducción. No es recomendable la utilización del nilotinib durante el tiempo de embarazo, a menos que sea estrictamente necesario. Si se llegara a utilizar durante el tiempo que dura el embarazo, la paciente debe ser informada de los posibles riesgos que puede tener el feto.
Se debe advertir a las pacientes que tienen alguna posibilidad de quedar embarazadas durante el tratamiento, que deben utilizar métodos anticonceptivos eficaces mientras dure la terapia con el nilotinib.
Lactancia
Hasta el momento no se conoce si el nilotinib es excretado a través de la leche materna. Los estudios realizados en ciertos animales muestran que el nilotinib se excreta en la leche materna. Por eso no es aconsejable realizar la lactancia durante el tiempo que dure el tratamiento con el nilotinib.
Interacciones
El nilotinib es metabolizado primordialmente en el hígado y también es un tipo de sustrato de la glicoproteína-P (gp-P), una bomba que tiene la capacidad de extraer de las células una gran cantidad de medicamentos. Por esto, la absorción y siguiente eliminación de nilotinib se absorbe de forma sistémica, pueden llegar a verse influenciadas por ciertas sustancias que pueden llegar a afectar al CYP3A4 y/o a gp-P.
Los potentes cohibidores de la CYP3A4 (que son por ejemplo el itraconazol, el voriconazole, el ketoconazol, el ritonavir, la claritromicina y la telitromicina) pueden llegar a disminuir de manera significativa, la depuración del nilotinib con el aumento correspondiente de sus posibles efectos tóxicos. Por el contrario, los medicamentos que son inductores de este tipo de enzima (como son por ejemplo la rifampina, los barbitúricos, la fenitoína, entre otros) pueden llegar a disminuir los niveles del plasma del nilotinib, y llegar a causar un fracaso a nivel terapéutico.
Por otra parte, el nilotinib es un cohibidor que posee una relativa potencia de las isoenzimas del citocromo P450, CYP3A4, CYP2C8, CYP2C9, CYP2D6 y UGT1A1 y, por lo tanto, puede llegar a disminuir la depuración de todos los medicamentos que usan estas vías para poder realizar su metabolismo.
Aunque no se tienen datos de estudios realizados de manera específicas sobre estas posibles interacciones, es recomendable tener cierta precaución en especial con la utilización en conjunto del nilotinib y fármacos que presentan con un margen estrecho a nivel terapéutico.
Algunos de los medicamentos cuya farmacocinética puede llegar a verse modificada por el nilotinib son: el astemizol, la cisaprida, la pimozida, la quinidina, la terfenadina, el bepridil o alcaloides ergóticos (como son la ergotamina, la dihidroergotamina). De igual forma, dado que la warfarina es metabolizada por CYP2C9 y CYP3A4, se debe consumir con cierta con precaución. También se deberán considerarse otros fármacos anticoagulantes.
Los cohibidores de la bomba de protones (como son por ejemplo el omeprazol) pueden llegar a incrementar el pH gástrico, y pueden llegar a disminuir de forma ligera la absorción del nilotinib. Pero sin embargo, este tipo de disminución no parece tener algún tipo de efectos significativos a nivel clínico, pero es recomendable el uso de los antiácidos para estos efectos.
El nilotinib se debe utilizar con mucha precaución en los pacientes que se encuentran bajo la terapia con fármacos antiarrítmicos como son la procainamida, la quinidina, la amiodarona, la disopiramida y el sotalol y otros fármacos que pueden llegar a provocar una prolongación del intervalo QT como por ejemplo la cloroquina, el haloperidol, la metadona, la halofantrina, la claritromicina y la moxifloxacina.
El Hypericum perforatum, (conocida también como la hierba de San Juan) puede llegar a disminuir de manera significativa la exposición al nilotinib, incrementando de manera potencial el riesgo del la falla terapéutica.
La fruta conocida como el pomelo tiene la 6,7-dihidroxibergamotina, que es una furanocumarina que cohibe la CYP 3A4 de los enterocitos. Es recomendable evitar el consumo del jugo de esta fruta mientras dure la terapia con los medicamentos que son metabolizados por este tipo de enzima, inclusive el nilotinib, ya que podría llegar a producirse un incremento de los efectos adversos.
Reacciones adversas
Las reacciones adversas del tipo no hematológicas que se presentan con más frecuencia, y que son provocadas por el consumo del nilotinib son: erupciones, sarpullido, picazón o prurito, náuseas o vómitos, fatiga y dolor de cabeza (cefalea). La gran mayoría de estas reacciones adversas pueden llegar a ser de una intensidad leve a una intensidad moderada.
Otros tipos de reacciones adversas que se presentan con menor frecuencia son: el estreñimiento, la diarrea, el dolor en los huesos, el dolor en las articulaciones (artralgia), los espasmos musculares y el edema periférico (inflamación del rostro, los pies, las manos), de una intensidad que va de leve a moderada.
El bajo conteo de células sanguíneas. Los niveles de los glóbulos blancos y rojos y de las plaquetas pueden llegar a reducirse de manera temporal. Esto puede traer como consecuencia que se corra un mayor riesgo de sufrir una infección, de anemia y/o de hemorragias.
Existen otras reacciones adversas que se presentan con menor frecuencia en los pacientes que son tratados con nilotinib (incidencia de este tipo de reacciones está entre 10% y 29%): concentración alta de las enzimas hepáticas, presencia de fiebre, el dolor en los músculos, tos, la debilidad general, los distintos síntomas de resfriado, el dolor en la zona del abdomen, el dolor de espalda, ahogo o dificultad para respirar (disnea), los altos niveles de glucosa en la sangre.
Un efecto adverso que es muy poco frecuente pero que presenta un posible peligro del nilotinib es la toxicidad hepática. Se pueden elevar las cantidades de las transaminasas, las bilirrubina y el lactato deshidrogenasa. Se debe vigilar las funciones hepáticas mientras esté consumiendo la terapia con este medicamento.
La toxicidad a nivel hematológico viene derivada de la terapia que incluye la mielosupresión: la trombocitopenia (reducción del número de plaquetas que circulan en el torrente sanguíneo que se encuentra por debajo de los niveles normales) (27%), neutropenia (la reducción aguda o crónica de granulocitos en la sangre) (15%) y anemia (falta de células rojas en la sangre) (13%).
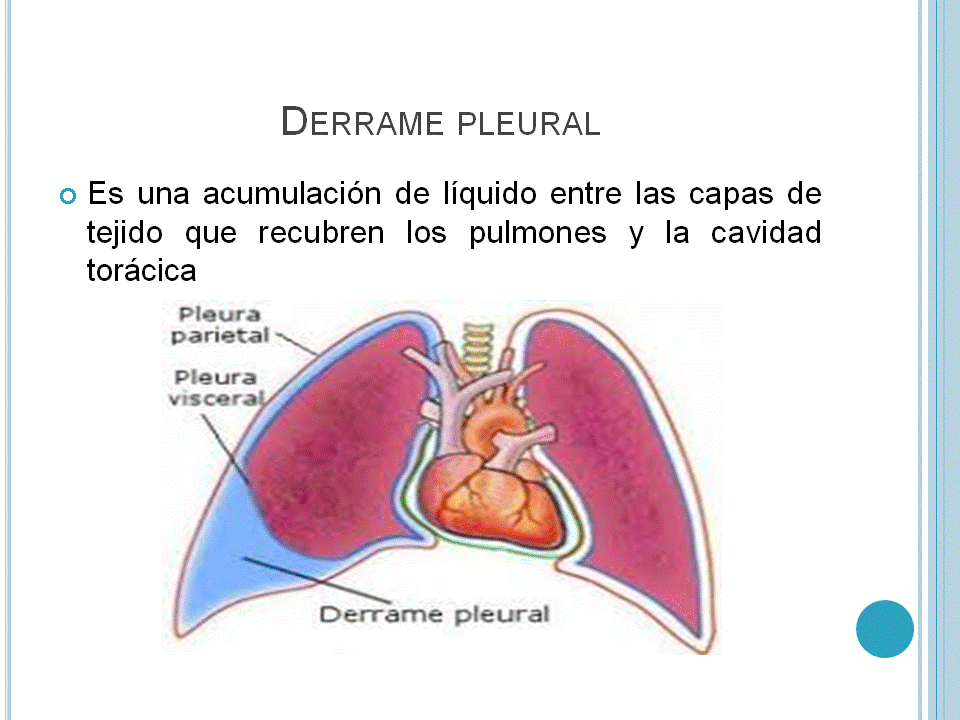
En más de un 1% de los pacientes que tienen terapia con nilotinib, se ha presentado derrame de pleura y de pericárdico así como ciertas complicaciones que son derivadas por la retención de líquidos. Se ha presentado deficiencia cardíaca congestiva en un 1% de los pacientes que tienen el tratamiento, la hemorragia a nivel gastrointestinal se presenta en el 3% de los pacientes y la hemorragia en el sistema nervioso central se presenta en el 1% de los pacientes.
Se ha presentado un valor de intervalo QTc por encima de los 500 ms en menos del 1% de los pacientes que consumen nilotinib, pero no se han presentado episodios de «Torsade de Pointes» (ni transitorios, ni sostenidos).
El presente artículo es netamente de carácter informativo, en ningún momento se trata de sustituir la opinión del médico especialista, por eso siempre es recomendable el consultar con el médico antes de iniciar cualquier tratamiento con fármacos.
Actualizado el 16 enero, 2020