En este artículo hablaremos de tocilizumab es un medicamento que se utiliza en combinación con otros fármacos para combatir la artritis, también hablaremos de sus indicaciones, mecanismo de acción, dosis, contraindicaciones, reacciones adversas y algo más.
El tocilizumab: ¿Qué es?
El tocilizumab es un tipo de anticuerpo monoclonal recombinado y humanizado al receptor de la interleucina 6 (IL-6) de la subclase Igg1k, con la estructura polipeptídica típica de la inmunoglobulina H2L2. La cadena ligera y la cadena pesada constan de 214 y 448 aminoácidos, de forma respectiva.
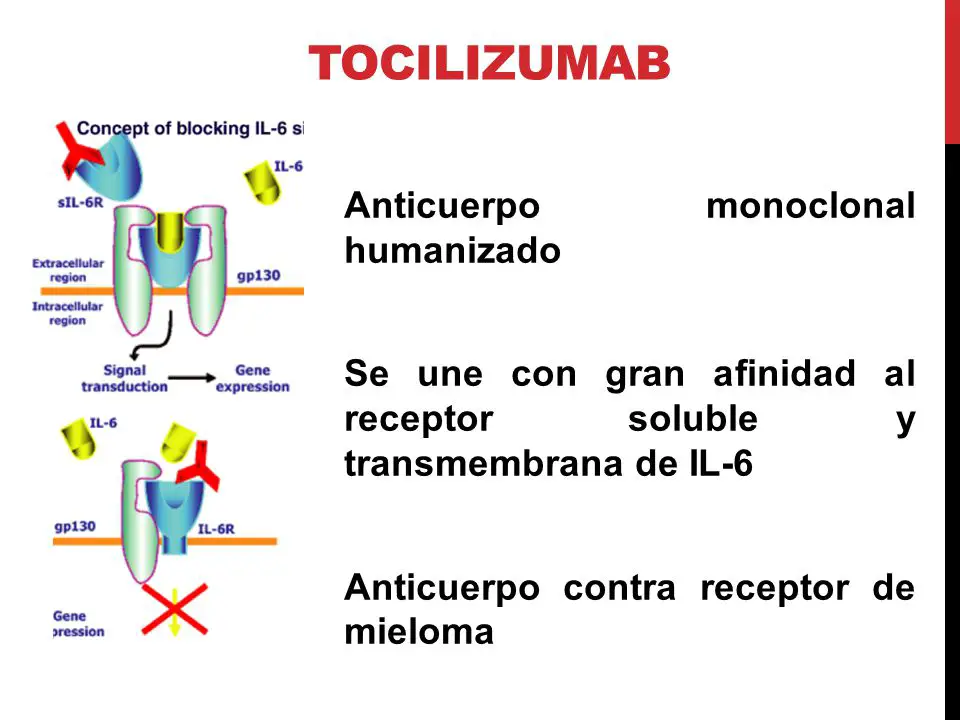
La inyección de tocilizumab es un tipo de fármaco conocido como cohibidores receptores de interleucina-6 (IL-6). Su función es la de bloquear la acción de la interleucina-6, que es una sustancia que se encuentra en el organismo y que es la que provoca la inflamación.
Nombre comercial
El nombre comercial de el tocilizumab es: Ro Actemra que viene en presentación de solución inyectable de 20 mg/ml.
Mecanismo de acción
El tocilizumab se mezcla de forma específica a los receptores de IL-6 (sIL-6R y mIL-6R) tanto a los solubles como a los que están unidos a la membrana, cohibiendo la señalización de la IL-6 mediada por medio de estos receptores. La interleukina IL-6 es una de las citoquinas pleiotrópicas pro-inflamatorias generadas por una cantidad de tipos de células que incluyen las células T y las células B, los linfocitos, los monocitos y los fibroblastos.
La IL-6 se ha mostrado que se encuentra involucrada en distintos procesos fisiológicos como es la activación de células T, la estimulación de la secreción de la inmunoglobulina, el inicio de la síntesis hepática de proteínas y el estímulo de la proliferación y diferenciación de las células pioneras hematopoyéticas. La IL-6 también se produce en las células sinoviales y endoteliales aglomerandose en las articulaciones, que son afectadas por diferentes procesos inflamatorios como es la artritis reumatoide.
Farmacocinética
La farmacocinética de el tocilizumab se ha estudiado en personas sanas y en pacientes que padecen artritis reumatoide (AR), resultando muy parecida en las dos poblaciones. La depuración del tocilizumab se reduce con el incremento de la dosis. Con una dosis única de 10 mg/ kg en los pacientes con artritis reumatoide (AR), la depuración promedio es de 0,29 más o menos 0,10 ml/h/kg y la semi-vida terminal aparente (t ½) es de 151 más o menos 59 horas (alrededor de siete 7 días).
En los pacientes que tienen artritis reumatoide que fueron tratados con dosis de tocilizumab de 4 y 8 mg/kg cada cuatro (4) semanas, por un periodo de veinticuatro (24) semanas se presentaron cantidades plasmáticas máximas y AUCs que no presentaban proporcionalidad con las dosis. Posteriormente a una dosis de 8 mg/kg el AUC y la Cmax fueron 2.7 y 6.5 veces más grandes que con la dosis de 8 mg/kg. de manera respectiva.
Para las dosis de tocilizumab de 4 mg/kg aplicadas cada mes, las AUC, Cmin y Cmax que se encuentran determinadas en el estado estacionario fueron 13.000 más o menos 5.800 mg*h/mL, 1,49 más o menos 2,13 mg/ml y 88,3 más o menos 41,4 mg/ml, de manera respectiva. Se logró el estado estacionario para las Cmax y AUC posteriormente a la primera aplicación y posteriormente de 16 semanas para la Cmin. (Ver artículo cetrorelix)
Para las dosis de tocilizumab 8 mg/kg aplicadas cada cuatro (4) semanas, las AUC, Cmin y Cmax fueron de 35.000 más o menos 15.500 ug*h/mL, 9.74 más o menos 10,5 mg/ml, y 183 más o menos 85,6 mg/ml, de manera respectiva. Las relaciones de aglomeración de AUC y Cmax fueron 1,22 y 1,06, de manera respectiva.
Las AUC, Cmin y Cmax del tocilizumab se incrementaron con el incremento de peso corporal. Con un peso corporal de 100 kg o más, el promedio estimado (± SD) de las AUC, Cmin y Cmax de tocilizumab en el estado estacionario fueron 55.500 más o menos 14.100 ug*h/mL 19,0 más o menos 12,0 mg/ml, y 269 más o menos 57 mg/ml, de manera respectiva, que son más elevados que los valores de exposición para una población promedio de los pacientes. Por lo tanto, no es recomendable la aplicación de dosis por encima de 800 mg por medio de infusión.
Tras la aplicación por vía intravenosa de el tocilizumab se presenta una eliminación bifásica. En los pacientes que tienen artritis reumatoide (AR) el volumen central de la distribución es de 3,5 L y el volumen de la distribución a nivel periférico es 2,9 L, lo que viene a dar como resultado un volumen de distribución en el estado estacionario de 6,4 L.
En los pacientes pediátricos que presentan poliartritis juvenil, el volumen central de la distribución es de 1,98 L, el volumen de la distribución a nivel periférico es 2,1 L, lo que da como resultado un volumen de distribución en el estado estacionario de 4,08 L.
En los pacientes pediátricos que tienen artritis juvenil idiopática, el volumen central de la distribución es de 0,94 L, el volumen de la distribución a nivel periférico es de 1,60 L, que da como resultado un volumen de la distribución en el estado estacionario de 2,54 L.
La depuración total de el tocilizumab depende de la cantidad y es la suma de las depuraciones tanto lineal y como no lineal. La depuración lineal está estimada en 12,5 mL/h en la AR, en 5.8 mL/h en los pacientes pediátricos que tienen poliartritis juvenil y en 7.1 mL/ h en los pacientes pediátricos que tienen artritis idiopática juvenil.
El t ½ del tocilizumab depende de la cantidad. La t ½ aparente depende de la cantidad promedio que es de hasta once (11) días después de aplicada la dosis de 4 mg/kg, y de hasta trece (13) días para 8 mg/kg aplicados en los dos casos de pacientes que tienen AR.
El t ½ de tocilizumab en los pacientes pediátricos que tienen poliartritis juvenil, es de hasta dieciséis (16) días para ambas categorías de peso corporal (8 mg/kg en los pacientes cuyo peso corporal igual o mayor a 30 kg o 10 mg/kg para los pacientes cuyo peso corporal es menor a los 30 kg), mientras que en los pacientes pediátricos que tienen artritis juvenil idiopática la t ½ de el tocilizumab es de hasta unos 23 días para ambas categorías de peso corporal en la semana doce (12).
En los casos de deficiencia renal leve, (la depuración de la creatinina es menor a 80 ml por minuto y superior de 50 ml por minuto) no afectando a la farmacocinética de el tocilizumab. No se requiere de un ajuste en la dosis para los pacientes que tienen deficiencia renal leve.
Indicaciones para el tocilizumab
El tocilizumab se usa solo y en conjunto con otros fármacos para tratar de aliviar los síntomas de algunas clases de artritis y de otros tipo de condiciones, entre las que se incluyen:
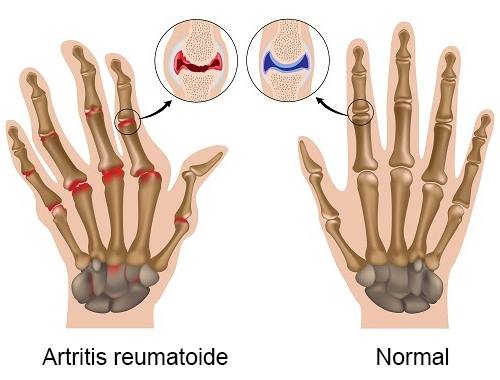
-Artritis reumatoide (es una clase de condición en la que el organismo ataca sus propias articulaciones, provocando dolor, hinchazón y hasta la pérdida de la función), en las personas que no han podido recibir ayuda de otros fármacos antireumáticos que puedan modificar la enfermedad (DMARD).
-Arteritis de células gigantes (es una condición que provoca inflamación de los vasos sanguíneos, en particular en la zona del cuero cabelludo y de la cabeza).
-Artritis idiopática juvenil poliarticular (PJIA; una clase de artritis infantil que llega a causar algunos daños a cinco o más articulaciones durante los primeros seis meses de la enfermedad, provocando mucho malestar, inflamación o pérdida de la función) en los pacientes pediátricos de más de 2 años de edad.
-Síndrome de liberación de citoquina (es una reacción muy grave y potencialmente mortal) que se presenta en pacientes adultos y niños de más de 2 años de edad después de haber recibido cierto tipo de infusiones de inmunoterapia. (Ver artículo promestrieno)
-Artritis idiopática juvenil sistémica (SJIA; una condición que se presenta en los niños que causa hinchazón en distintas zonas del organismo, provocando fiebre, mucho malestar e hinchazón de las articulaciones, hasta llegar a perder el funcionamiento y retrasando el desarrollo y el crecimiento) en pacientes pediátricos de más de niños de 2 años de edad.
https://www.youtube.com/watch?v=yzVje0YBMDo
Dosis
–Para tratar pacientes adultos que tienen artritis moderada a severamente activa que no han presentado una respuesta adecuada a uno o más de los medicamentos antirreumáticos, que son modificadores de la enfermedad.
- Aplicación intravenosa:
Para los adultos: la dosis que se recomienda de el tocilizumab es de 4 mg/kg cada 4 semanas, aplicada como una infusión por goteo intravenoso única (de 60 minutos de duración), continuando con un incremento a 8 mg/kg cada 4 semanas.
El tocilizumab se puede usar como monoterapia o de manera en conjunto con el metotrexato u otros medicamentos. Si se llegan a producir algunos efectos secundarios (como por ejemplo una elevación de las enzimas hepáticas) es recomendable una disminución de la dosis de 8 mg por kg a 4 mg por kg. No se recomiendan dosis mayores a 800 mg para los pacientes que tienen artritis reumatoide.
-Para tratar la artritis idiopática juvenil poliarticular (PJIA) en los pacientes pediatricos a partir de los dos (2) años de edad.
Aplicación intravenosa
Para niños menores de 2 años: la dosis que se recomienda de el tocilizumab en los pacientes que tienen PJIA, aplicada una vez cada 4 semanas en infusión por goteo intravenoso único de 1 hora es:
En pacientes cuyo peso es menor de 30 kg de peso la dosis es: 10 mg por kg.
En los pacientes cuyo peso es igual o más de 30 kg de peso la dosis es: 8 mg por kg.
-Para tratar la artritis idiopática juvenil sistémica (SJIA)
Aplicación intravenosa
Para los niños menores de 2 años: la dosis que se recomienda de tocilizumab para los pacientes SJIA, aplicada una vez cada 2 semanas como infusión por goteo intravenoso única de 1 hora es:
En los pacientes cuyo peso es menor de 30 kg la dosis es: 12 mg por kg.
En los pacientes cuyo peso es igual o más de 30 kg la dosis es: 8 mg por kg.
Contraindicaciones
El tocilizumab no debe ser administrado pacientes que tiene alergia o hipersensibilidad conocida al medicamentos o a cualquiera de los elementos que componen su fórmula.
Se han presentado infecciones graves y a veces hasta fatales ocasionadas por bacterias, micobacterias, hongos patógenos, virus, protozoos u otras clases de microorganismos en los pacientes que son tratados con medicamentos inmunosupresores, inclusive el tocilizumab en los casos de artritis reumatoide.
Las infecciones graves que se presentan con más frecuencia son: la neumonía, las infecciones del tracto urinario, la gastroenteritis, la celulitis, el herpes zoster, la diverticulitis y la sepsis bacteriana. Entre las diferentes infecciones oportunistas, que se han reportado en el caso del tocilizumab son la tuberculosis, la aspergilosis, la candidiasis y la neumocistosis. (Ver artículo progesterona)
Los pacientes tenían infecciones diseminadas, y la gran mayoría estaban siendo tratados con inmunosupresores en conjunto como el metotrexato o los corticosteroides.
El tocilizumab no debe ser aplicado en los pacientes que tienen una infección activa, inclusive las infecciones localizadas. Los riesgos y beneficios de la terapia se deben considerar previamente al inicio del tocilizumab en los pacientes:
Pacientes que presentan infección crónica o recurrente; pacientes que han estado expuestos al virus de a tuberculosis; los pacientes que tienen una historia de graves o una infección oportunista; los pacientes que han estado o viajado a áreas tuberculosis o micosis endémicas, o con ciertas condiciones subyacentes que puedan llegar a predisponer a la infección.
Los pacientes deben ser vigilados estrechamente para poder comprobar el desarrollo de los signos y síntomas de la infección, mientras dure y posteriormente a la terapia con tocilizumab. El tocilizumab se debe detener si el paciente llega a desarrollar una infección grave, una infección de tipo oportunista o de una sepsis.
Si un paciente llega a desarrollar una infección nueva durante el el tiempo de la terapia con tocilizumab, se debe someter a una evaluación diagnóstica rápida y completa para poder llegar a comprobar su inmunodeficiencia y poder iniciar una terapia con los antimicrobianos que más se adecuen.
Se debe tomar en cuenta un tratamiento anti-tuberculosis antes de comenzar el tocilizumab en los pacientes que tienen antecedentes de tuberculosis latente o activa. Se debe consultar con el médico sobre la terapia de la tuberculosis para poder ayudar a tomar la decisión del tratamiento anti-tuberculoso más adecuado para un paciente de manera individual.
Se han presentado casos de reactivación viral cuando se usan tratamientos biológicos inmunusupresores. En el caso del tocilizumab se presentaron agravación de las infecciones por herpes zoster. No se conoce si esta reactivación puede llegar a ocurrir con el virus de la hepatitis ya que en los ensayos clínicos no había pacientes con hepatitis.
La terapia con el tocilizumab se ha ligado con una mayor presencia de neutropenia. No es recomendable comenzar la terapia con tocilizumab en los pacientes que tienen un conteo bajo de neutrófilos (menos de 2.000 neutrófilos por mm³). En los pacientes que llegan a desarrollar un conteo absoluto de neutrófilos de menos de 500 por mm³ no es recomendable continuar con la terapia. Los neutrófilos se deben controlar cada 4 a 8 semanas.
De la misma manera, la terapia con tocilizumab se ha ligado con una disminución en los conteos plaquetarios, si bien esta disminución no se ligó a episodios hemorrágicos de gravedad. No es recomendable comenzar la terapia con tocilizumab en los pacientes que tienen un conteo plaquetario inferior a 100.000 por mm³. En los pacientes que llegaron a desarrollar un conteo plaquetario inferior a 50.000/ mm³ no es recomendable continuar el tratamiento. Las plaquetas se deben controlar cada 4 a 8 semanas.
La terapia con tocilizumab se ligó con una mayor presencia de alteraciones de las transaminasas. Estas alteraciones no presentaron lesiones de tipo permanentes o que fueran clínicamente evidentes. Se presentó un incremento de la frecuencia y de la magnitud de dichas elevaciones cuando se usaron medicamentos potencialmente hepatotóxicos (como por ejemplo, el metotrexato) en conjunto con el tocilizumab.
No es recomendable comenzar la terapia con tocilizumab en los pacientes que tienen altos los niveles de las transaminasas ALT o AST por encima de 1,5 x ULN. En los pacientes que llegan a presentar altos niveles de ALT o AST por encima de 5x ULN no es recomendable seguir con la terapia. Los niveles de ALT y AST se deben controlar cada 4 a 8 semanas.
La terapia con tocilizumab se ligó al incremento de los lípidos (colesterol total, triglicéridos, LDLs y HDLs). Se deben hacer evaluaciones de los lípidos unas 4 a 8 semanas una vez iniciado el tratamiento con tocilizumab y, después, realizarlos a intervalos de 24 semanas aproximadamente.
Las vacunas vivas no debe ser aplicadas en simultáneo con tocilizumab. No se tienen datos sobre la posible transmisión secundaria de la infección partiendo de individuos que han sido inyectados con vacunas vivas a los pacientes que consumen tocilizumab.
Tampoco se disponen de datos sobre la eficiencia de la vacunación en los pacientes que fueron tratados con tocilizumab. Debido a que la cohibición de IL-6 puede llegar a interferir con la respuesta normal inmune a los nuevos antígenos, es recomendable que todos los pacientes, en especial los pacientes pediátricos sean vacunados según los planes habituales antes de comenzar la terapia con tocilizumab.
Embarazo
El tocilizumab se ubica dentro de la categoría C de posible riesgo en el embarazo. No se han hecho estudios formales y bien controlados en pacientes embarazadas, por lo que el tocilizumab se debe aplicar durante el tiempo de gestación solamente si el beneficio posible justifica el posible riesgo para el feto.
Lactancia
Se desconoce si el tocilizumab es excretado a través de la leche humana o si es absorbido de forma sistémica posteriormente a su ingestión. Debido a que gran cantidad de medicamentos son excretados por medio de la leche humana y debido a las posibles de reacciones no deseadas para los lactantes, se debe tomar la decisión si se suprime la lactancia o el medicamento, tomando en cuenta la importancia del fármaco para la madre.
Interacciones
Los datos in vitro proponen que la IL-6 disminuye la expresión del mRNA para algunas isoenzimas CYP450, inclusive para CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6 y CYP3A4, y esta disminución de la expresión se invierte por la co-incubación con tocilizumab en cantidades clínicamente relevantes.
Por tanto, la cohibición de señalización de IL-6 en los pacientes que tienen AR que son tratados con tocilizumab, puede llegar a restaurar las acciones de la CYP450 niveles más elevados que en ausencia de el tocilizumab, lo que lleva a un incremento del metabolismo de medicamentos que son sustratos de la CYP450. (ver artículo tiamazol)
Este efecto es importante clínicamente para los sustratos de CYP450 presentando un índice terapéutico bastante estrecho, donde la dosis se debe ajustar de forma individual. Al comenzar la terapia con el tocilizumab en los pacientes que están en tratamiento con esta clase de fármacos, se requiere vigilar el efecto terapéutico (como por ejemplo, la warfarina) o la cantidad de medicamento (como por ejemplo, la ciclosporina o teofilina) y la dosis individual del fármaco debe ser ajustada según se requiera.
El efecto que produce el tocilizumab sobre la CYP2C8 o sobre los transportadores (como por ejemplo, P-gp) no se conoce.
La simvastatina es un sustrato de las CYP3A4 y OATP1B1. Las dosis de la simvastatina en los pacientes que tienen artritis reumatoide (AR), deben tener en cuenta las exposiciones menores que pueden llegar a resultar cuando se inicie la terapia con tocilizumab o exposiciones más altas cuando se suspenda la terapia.
El omeprazol es un sustrato para las CYP2C19 y CYP3A4. En los pacientes con artritis reumatoide (AR) que consumen 10 mg de omeprazol, la exposición al omeprazol es de 2 veces más alta aproximadamente que la que se presenta en individuos sanos debido a la cohibición de su metabolismo por la IL-6. En los pacientes que tienen artritis reumatoide (AR) que consumen 10 mg de omeprazol, este efecto se revierte por el tocilizumab.
Después de aplicada la infusión (8 mg/kg) el tocilizumab, el AUC del omeprazol se reduce en un 12% para los metabolizadores lentos y en 28% para los metabolizadores rápidos y fueron superiores de forma leve a las presentadas en individuos sanos.
Algo similar pasa con el dextrometorfano que es un sustrato de para las CYP2D6 y CYP3A4. En los pacientes que tienen artritis reumatoide (AR) que son tratados con 30 mg de dextrometorfano, la exposición al dextrometorfano se compara a la de los individuos sanos, pero la exposición a su metabolito, dextrorfano (un sustrato de CYP3A4), es una pequeña fracción de la que se presenta en individuos sanos.
Tras una semana de la aplicación de una sola infusión de el tocilizumab (8 mg por kg), la exposición al dextrometorfano disminuyó en un 5% aproximadamente, presentándose una reducción mayor (29%) en los niveles de el dextrorfano posteriormente a la infusión de el tocilizumab.
Reacciones adversas
Las reacciones adversas que se presentan más comúnmente, y que se presentan en por lo menos un 5% de los pacientes que son tratados con el tocilizumab en monoterapia o en conjunto con otros medicamentos son: las infecciones del tracto respiratorio superior, la nasofaringitis, las cefaleas, la tensión alta y el incremento de la ALT.
Las reacciones adversas más comunes que necesitaron la suspensión del tocilizumab, fueron el incremento de los valores de las transaminasas y de las infecciones de gravedad. Las infecciones más frecuentes (5% a 8% de los pacientes) fueron infecciones ubicadas en el tracto respiratorio superior y la nasofaringitis. Otra clase de infecciones fueron las del tracto urinario, la celulitis, el herpes zoster, la gastroenteritis, la diverticulitis y la sepsis.
Los casos que se presentaron de perforación intestinal fueron, en su gran mayoría, debido a complicaciones de la diverticulitis inclusive la peritonitis purulenta generalizada, la perforación gastrointestinal inferior, las fístulas y los abscesos. La gran mayoría de los pacientes que presentaron perforaciones gastrointestinales estaban ingiriendo medicación en conjunto con fármacos antiinflamatorios no esteroides (AINES), los corticosteroides o el metotrexato.
Las reacciones adversas ligadas a la infusión (que se presentan dentro de las 24 horas del comienzo de la infusión), se observaron en el 8% y el 7% de los pacientes que fueron tratados con 4 mg/kg y 8 mg /kg de tocilizumab, agregado a otros medicamentos anti-inflamatorios de forma respectiva, comparado con el 5% de los pacientes en el grupo de placebo más otros medicamentos.
El caso que se presentó más frecuentemente durante la infusión fue la tensión alta (1% para ambas dosis), mientras que el efecto adverso que se presentó más frecuencia se presentó en las primeras 24 horas tras culminar la infusión fueron: cefaleas (1% para los ambas dosis) y ciertas reacciones cutáneas (1% para ambas dosis), inclusive erupción cutánea, picazón y urticaria. Estos eventos no fueron una limitación para la terapia.
De un total de 2.876 paciente en los que se presentaron en la semana 24 los anticuerpos anti-tocilizumab, cuarenta y seis (46) pacientes (2%) que llegaron a desarrollar anticuerpos anti-tocilizumab positivos. De este grupo, solamente 5 pacientes presentaron una reacción de hipersensibilidad ligada, médicamente de cierta significancia que llevó a la suspensión del medicamento. Treinta (30) pacientes (1%) llegaron a desarrollar anticuerpos neutralizantes.
Al finalizar la semana 24, se llegaron a diagnosticar 15 neoplasias malignas en los pacientes que fueron tratados con tocilizumab, comparados con 8 tumores malignos que se presentaron en los pacientes de control. Sin embargo, la presencia tan ajustada a la exposición fue parecida en los grupos de tocilizumab (1,32 casos por 100 pacientes-año), y en el grupo de placebo más medicamentos anti-inflamatorios. (1,37 de casos por 100 pacientes-año).
Otras reacciones adversas menos frecuentes y médicamente relevantes que se presentan con una incidencia de menos de 2% en los pacientes con artritis reumatoide (AR) que son tratados con el tocilizumab en estudios controlados fueron:
-Infecciones e infestaciones: como el herpes simples oral.
-Los trastornos gastrointestinales: como la estomatitis, la úlcera gástrica.
-Las exploraciones complementarias: incremento del peso, incremento de la bilirrubina total.
-En la sangre y los distintos trastornos del sistema linfático: como la leucopenia.
-Los trastornos a nivel general y alteraciones en la zona de la aplicación: como el edema periférico.
-Los trastornos respiratorios, torácicos y mediastínicos: como la disnea, la tos.
-Los trastornos oculares: como la conjuntivitis.
-Los trastornos renales: como la nefrolitiasis.
-Los trastornos endocrinos: como el hipotiroidismo.
El presente artículo es de carácter netamente informativo, no se pretende sustituir la opinión del médico especialista, siempre se recomienda consultar con el médico antes de iniciar cualquier tratamiento con medicamentos.
Actualizado el 16 enero, 2020