En el presente artículo hablaremos del canakinumab que es un anticuerpo que se utiliza para el tratamiento de los casos de síndromes periódicos asociados a la criorpirina, también hablaremos de de sus indicaciones, dosis, reacciones adversas, interacciones y algo más.
El canakinumab: ¿Qué es?
El canakinumab es un anticuerpo monoclonal humanizado que se obtienen por medio de la tecnología del ADN recombinante en las células de hibridoma Sp2/0 de ratón. Es un anticuerpo monoclonal anti-IL-1β humana anticuerpo del isotipo IgG1/κ.
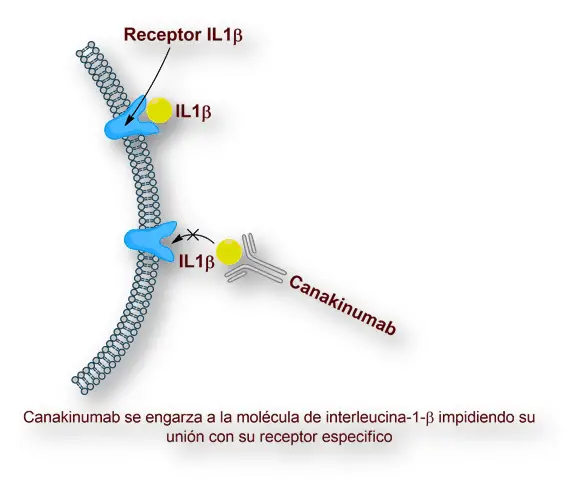
El canakinumab se fusiona a la IL1β humana y de ésta forma llega a neutralizar su actividad mediante la interrupción de su interacción con los receptores de IL-1, pero no llega a es un antagonista de IL-1α o del receptor de IL-1 (IL-1ra). El canakinumab se usa para tratar los síndromes periódicos que están ligados a la criorpirina (CAPS), y en la gota artrítica en los pacientes que no presentan una respuesta responden adecuada a la colchicina o a los corticoides.
Nombre comercial
El nombre comercial del canakinumab es: ILARIS, que viene en una presentación de vial conteniendo 150 mg de polvo para preparar solución para aplicación vía subcutánea o infusión intravenosa.
Mecanismo de Acción
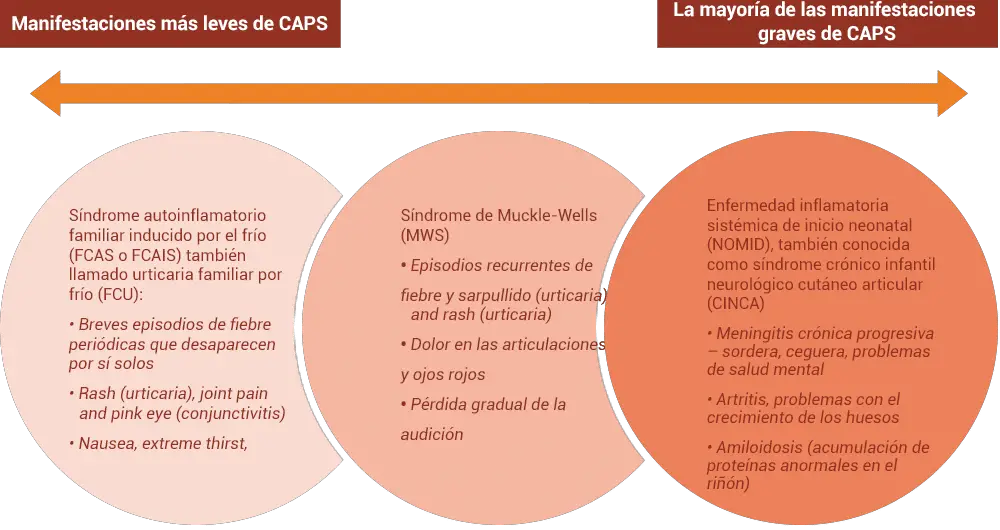
Los síndromes periódicos asociados a la criorpirina CAPS, se refieren a los síndromes genéticos raros que por lo general son provocadas por las mutaciones en el NLRP-3 [familia de dominios de unión a nucleótidos ricos en leucina (NLR), que tienen el dominio pirina3] . Este gen es también llamado el causante del síndrome-1 autoi-inflamatorio provocado por frío [CIAS1].
Las enfermedades que son dependientes de la criorpirina, se llegan a heredar siguiendo un patrón autosómico dominante con descendencia masculina y femenina que son afectados por igual. Las características más comunes a todas éstas enfermedades son la fiebre, la urticaria, erupción de tipo artralgia, la mialgia y la conjuntivitis.
El NLRP-3 gen es el encargado de codificar la proteína criopirina, que es un elemento importante del inflamasoma. La criopirina es la encargada de regular la proteasa caspasa-1 y de controlar la activación de la interleucina-1 beta (IL-1β). Las mutaciones en NLRP-3 llegan a resultar en un inflamasoma hiperactivo con una liberación exagerada de IL-1β activada que favorece la inflamación.
Los indicadores de la actividad de la enfermedad inflamatoria proteína C reactiva y amiloide A sérico, están en niveles muy altos en los pacientes que tienen síndromes periódicos asociados a la criorpirina. Estos indicadores, que están ligados a la amiloidosis sistémica se llegan a normalizar posteriormente a un tratamiento con el canakinumab.(Ver artículo tiamazol)
Farmacocinética
Posteriormente a la aplicación de la inyección por vía subcutánea de una dosis de 150 mg, las cantidades plasmáticas máximas de el canakizumab de 16 ± 3,5 ug / mL se llegan a obtener a los siete (7) días aproximadamente después de la aplicación. El semi-vida terminal es de unos veintiséis (26) días. La biodisponibilidad absoluta de el canakinumab por vía subcutánea está estimado en un setenta (70) %.
La farmacocinética de el canakinumab es lineal en el periodo de las dosis de 0,30 a 10 mg/kg aplicadas en una infusión intravenosa, o de las dosis de 150 a 300 mg aplicada por medio de inyección subcutánea.
El canakinumab se fusiona a IL-1β suero. El volumen de distribución va ha depender del peso corporal llegándose a estimar en 6,01 litros para un paciente típico de 70 kg. La relación de acumulación que se espera es de 1,3 veces posteriormente a los seis (6) meses de una dosificación por vía subcutánea de 150 mg de canakinumab cada ocho (8) semanas.
De igual manera, la depuración del canakinumab va a depender del peso corporal llegándose a estimar en 0,174 L/día en un paciente típico de unos setenta (70) kg de peso.
En el caso de los niños, las cantidades máximas de canakinumab se llegan a obtener entre los dos (2) a siete (7) días después de una aplicación única subcutánea de 150 mg o de 2 mg/kg. La semi-vida terminal es de veintidós (22) a veinticinco (25) días.
Indicaciones
El canakinumab está indicado para:
1) Síndrome de fiebre periódica autoinflamatorios en adultos, adolescentes y niños a partir de los dos (2) años de edad:
– Síndrome periódicos asociados a la criopirina (CAPS) en los que están incluidos: el síndrome de Muckle-Wells (MWS), la enfermedad neonatal multisistémica inflamatoria (NOMID) / síndrome infantil neurológico cutáneo y articular crónico (CINCA), la manifestaciones de gravedad del síndrome autoinflamatorio familiar causado por el frío (FCAS) /urticaria familiar fría (FCU) que llegue a presentar signos y síntomas que vayan más allá de la erupción de tipo urticaria provocada por el frío.
– Síndrome periódico asociado al receptor del factor de necrosis tumoral (TRAPS).
– Síndrome hiperinmunoglobulina D (HIDS)/deficiencia de mevalonato quinasa (MKD).
– Fiebre Mediterránea familiar (FMF).
2) Enfermedad de Still activa inclusive la enfermedad de Still en adultos (ESIA), y la artritis idiopática juvenil sistémica (AIJS) que se presenta en niños a partir de los dos (2) años de edad o en mayores que no han tenido una respuesta adecuada al tratamiento anterior con AINEs, y con los corticosteroides sistémicos. Puede aplicarse en monoterapia o en conjunto con el metotrexato. (Ver artículo progesterona).
3) Gota artrítica, tratamiento sintomático en adultos que tienen ataques con cierta frecuencia (por lo menos tres (3) ataques en los 12 meses anteriores) en los cuales se encuentra contraindicado el tratamiento con AINEs y con la colchicina, cuando no es tolerado, o no tienen una respuesta adecuada, y en cuyos casos no son adecuadas las aplicaciones de series repetidas de corticoides.
Enfermedades autoinflamatorias sistémicas
Las enfermedades autoinflamatorias sistémicas incluyen al conjunto de enfermedades que son raras, y que estás poseen similitudes por la aparición de ciertos episodios inflamatorios del tipo agudo y de forma recurrente, que son el resultado de una disregulación del control en los procesos inflamatorios.
Desde sus descripciones clínicas respectivas, se había presentado un patrón muy claro de tipo hereditario mendeliano para algunos de los casos. Recientemente se han logrado identificar los defectos genéticos y moleculares profundos al lograr identificar las mutaciones que son responsables de enfermedad en los distintos genes que se encuentran relacionados con la respuesta inmune congénita y con la inflamación.
El concepto de la enfermedad autoinflamatoria sistémica se propuso en el año 1999 por el Dr. Kastner, del National Institute of Arthritis and Muskuloeskeletal and Skin Diseases (NIAMS), para asociar a las enfermedades que tenían algunas manifestaciones clínicas y bases fisiopatológicas en apariencia muy parecidas (como son los episodios febriles e inflamatorios que se presentan con cierta frecuencia).
Desde que apareció, se presentó una contraposición entre éstas enfermedades y las enfermedades del tipo autoinmunes, con las que pueden llegar a compartir algunas semejanzas de tipo clínicas, pero con las que se tienen diferencias evidentes en cuanto a la fisiopatológica, al no poder detectarse en las enfermedades autoinflamatorias los marcadores de una respuesta autoinmune (autoanticuerpos a títulos altos o células T específicas de antígenos propios).
Actualmente, se sugiere la disregulación del proceso inflamatorio como la base fisiopatológica en común para todas éstas enfermedades autoinflamatorias.
Enfermedad de Still
Es una enfermedad muy poco común que provoca fiebres altas, salpullido y dolor en las articulaciones. Puede conllevar a una artritis prolongada (crónica).
La enfermedad de Still es una versión más grave de la artritis idiopática juvenil (AIJ), que se comúnmente se presenta en los niños. Los adultos pueden llegar a presentar la misma afección, aunque es mucho menos común. También se conoce con el nombre de enfermedad de Still de inicio en el adulto (ESIA).
Menos de una (1) persona de cada 100,000 llega a presentar la ESIA por cada año. Esta es una dolencia que llega a afectar a las mujeres con mucha más frecuencia que a los hombres.
Las causas de la enfermedad de Still del adulto todavía son desconocidas. Tampoco se han podido identificar los factores de riesgo.
Gota artrítica
La gota es un tipo de artritis compleja que se presenta con frecuencia y que puede llegar a afectar a cualquier persona. Se representa por tener ciertos ataques de forma aleatoria y con intenso dolor, con inflamación, con enrojecimiento y con una hipersensibilidad en la mayoría de las articulaciones, pero se presenta con mayor frecuencia en la articulación que se encuentra en la base del dedo gordo del pie.
Un ataque de gota se puede llegar a presentar de forma repentina y con frecuencia, te puede llegar a despertar en medio de la noche con la sensación de ardor en el dedo gordo del pie (como si estuviera en llamas). La articulación que se ve afectada se pone caliente, inflamada y tan sensible que hasta el roce de la sábana puede llegar a parecer intolerable.
Los síntomas de la gota pueden llegar a ser alternos, pero hay maneras de controlarlos y de evitar las exacerbaciones.
https://www.youtube.com/watch?v=kOca85l4Ll4
Síntomas
Los signos y síntomas de la gota usualmente se presentan de manera repentina y, muy a menudo, durante la noche. Estos son algunos:
-Dolor en la articulaciones de cierta intensidad. Generalmente, la gota causa daños a las articulación mayor del dedo gordo del pie, pero se puede llegar a presentar en cualquier articulación. Las articulaciones que se ven afectadas con mayor regularidad son los tobillos, las rodillas, los codos, las muñecas y los dedos de las manos. Es muy probable que el dolor sea más intenso dentro de las primeras doce (12) horas después de que comienza.
-Molestia permanente. Probablemente los siguientes ataques lleguen a durar más tiempo y que puedan afectar a más articulaciones.
-Inflamación y enrojecimiento. Después de que ese dolor que es más intenso llega a desaparecer, es muy posible que quede algo de molestia en la articulaciones, esta puede llegar a durar por algunos días o semanas. Las articulaciones que se ven afectadas se inflaman, se vuelven muy sensibles, se enrojecen y calientan.
-La amplitud de movimiento se ve bloqueada. A medida que la enfermedad (gota) continua, es muy posible que no se pueda llegar a mover las articulaciones con total normalidad.
Dosis para el canakinumab
-Para tratar Síndromes Periódicos Asociados a la Criopirina (CAPS)
El canakinumab está indicado para la terapia de los Síndromes Periódicos Asociados a la Criopirina (CAPS) en los pacientes adultos, adolescentes y niños a partir de los dos (2) años de edad con un peso corporal de más de 7,5 k, incluyendo:
-El Síndrome de Muckle-Wells.
-La Enfermedad Neonatal Multisistémica Inflamatoria/Síndrome Infantil Neurológico Cutáneo y Articular Crónico.
-Las Manifestaciones de gravedad del Síndrome Autoinflamatorio Familiar producido por el frío/Urticaria Familiar Fría que llegue a presentar signos y síntomas que vayan más allá de la erupción de tipo urticaria producido por el frío.
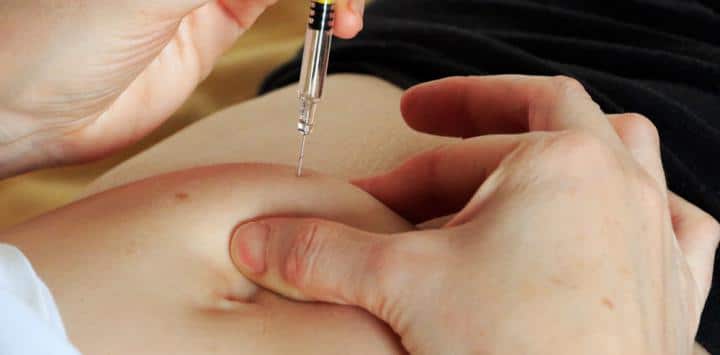
Aplicación subcutánea:
La dosis de inicio que se recomienda para los pacientes que tienen CAPS es:
Para los adultos, adolescentes y niños ≥ de 4 años de edad:
Dosis de 150 mg para los pacientes cuyo peso corporal sea más de cuarenta (40) kg.
Dosis de 2 mg/kg para los pacientes cuyo peso corporal sea entre quince (15) kg y cuarenta (40) kg.
Dosis de 4 mg/kg para los pacientes cuyo peso corporal sea entre 7,5 kg y quince (15) kg.
Para los niños de edad entre 2 a 4 años:
Dosis de 4 mg/kg para los pacientes cuyo peso corporal sea mayor o igual a 7,5 kg.
Se aplica cada ocho (8) semanas como una dosis única por medio de una inyección vía subcutánea.
En los pacientes que tienen una dosis inicial de 150 mg o 2 mg/kg, si no se llegara a conseguir una respuesta clínica de satisfacción (como la resolución de la erupción y los otros síntomas de tipo inflamatorios que son generalizados) una vez que pasaron los siete (7) días desde que se comenzó la terapia, puede llegar a considerar una segunda dosis de canakinumab de 150 mg ó 2 mg/kg.
Si, a continuación, se logra conseguir una respuesta completa a la terapia, se deben mantener las dosis altas de 300 mg o 4 mg/kg cada 8 semanas. Si no se llegara a conseguir una respuesta satisfactoria una vez que transcurrieron los siete (7 ) días de esta dosis incrementada, se puede llegar a considerar una tercera dosis de canakinumab a 300 mg o 4 mg/kg.
Si, sucesivamente, no se llega a obtener una respuesta completa a la terapia, se debe llegar a considerar el régimen con dosis altas de 600 mg o 8 mg/kg cada 8 semanas, en base a la valoración clínica realizada de forma individual.
Para los pacientes que tienen una dosis inicial de 4 mg/kg, si no se llegara a conseguir una respuesta clínica de satisfacción una vez pasados los siete (7) primeros días del comienzo de la terapia, se puede llegar a considerar una segunda dosis de el canakinumab 4 mg/kg. Si, sucesivamente, no se obtiene un resultado clínico favorable, se considera el cambio del régimen con dosis altas de 8 mg/kg cada 8 semanas, dependiendo de la valoración médica.
La experiencia clínica de regímenes con intervalos de dosis menores a cuatro (4) semanas o con dosis por encima de 600 mg o 8 mg/kg es muy limitada.
-Para tratar la Gota artrítica:
La terapia se debe iniciar y ser supervisado por el médicos especialista en el tratamiento para la gota artrítica y en la utilización de fármacos biológicos.
Aplicación vía subcutánea:
Para los adultos: la dosis que se recomienda de el canakinumab para estos individuos que presentan gota artrítica, es 150 mg aplicados por vía subcutánea como una dosis única durante el ataque. Para lograr un mejor resultado, se debe aplicar el canakinumab lo más pronto posible después de que se inicie el ataque de gota artrítica.
Los pacientes que no llegan a responder a la terapia de inicio no deben volver a ser tratados. En los pacientes que respondieron y que necesitan un retratamiento, se necesita un intervalo de por lo menos doce (12) semanas antes de que se pueda aplicar una nueva dosis de el canakinumab.
Reacciones adversas
Las reacciones adversas se han presentado a partir de los datos que se obtuvieron de 2.300 personas que han recibido la terapia con el canakinumab, inclusive a 250 niños aproximadamente (de edades comprendidas entre los 2 y los 17 años de edad) en estudios clínicos doble ciego y abiertos en los pacientes con CAPS, gota artrítica o con otro tipo de patologías mediadas por IL-1 beta y de voluntarios saludables. (Ver artículo promestrieno)
Las reacciones adversas que se presentaron con mayor frecuencia fueron infecciones (por ejemplo las infecciones en el tracto respiratorio superior y nasofaringitis). La gran mayoría de estos síntomas fueron de leves a moderados.
Las reacciones no deseadas que se observan siguiendo el sistema de clasificación por órganos y sistemas. Las categorías de frecuencia están definidas por los criterios siguientes: los muy regulares (> 1/10); los regulares (> 1/100 a < 1/10); los poco regulares (> 1/1.000 a < 1/100); las raras (>1/10.000 a < 1/1.000); las muy raras (< 1/10.000);
Las infecciones: que son muy frecuentes: son la nasofaringitis, la sinusitis, la celulitis, la gastroenteritis, la infección del tracto respiratorio superior (viral), la bronquitis, la faringitis, la neumonía, las infecciones del tracto urinario, la infección de oído, la influenza.
Los trastornos del sistema nervioso: que son frecuentes: son mareos/vértigo.
Los trastornos gastrointestinales: que son poco frecuentes: como la enfermedad por reflujo gastroesofágico.
Los trastornos musculoesqueléticos: que son frecuentes: como el dolor de espalda.
Los trastornos generales y modificaciones en el lugar de la aplicación: que son frecuentes: como la fatiga/astenia
Las reacciones en la zona de la inyección: mientras duraron los estudios clínicos, se presentaron reacciones en la zona de la inyección en 1,2% de los pacientes que fueron tratados con el canakinumab.
Las anomalías analíticas en los pacientes: reducción del conteo de glóbulos blancos; la reducción del conteo absoluto de neutrófilos, las dos son de carácter leve.
Contraindicaciones
El canakinumab está contraindicado para los pacientes que tienen alergia o hipersensibilidad al principio activo del canakinumab, o a alguno de los elementos que componen la fórmula. También está contraindicado en los casos de infecciones graves activas.
El canakinumab está ligado con un incremento en la ocurrencia de las infecciones graves. Por esto, se debe controlar de manera estrecha cuando aparecen signos y síntomas de alguna infección en los pacientes mientras dure el tratamiento y después del mismo. En el transcurso de la terapia con el canakinumab se han presentado casos de manera aislada de infecciones oportunistas o poco usuales. Sin embargo, se no se conoce la relación causal que existe entre el canakinumab y estos acontecimientos.
No es recomendable el uso uso en conjunto del canakinumab con los cohibidores del factor de necrosis tumoral (TNF), ya que éste podría llegar a incrementar el posible riesgo de infecciones graves.
Un 12% aproximadamente de los pacientes que tienen síndromes periódicos ligados a la criorpirina son sometidos a una prueba a nivel cutáneo PPD (derivado proteínico purificado), esta prueba dio un resultado positivo sin que hubiera evidencia clínica de la existencia de una infección de tipo tuberculosa latente o activa.
No se conoce si la utilización de cohibidores de interleucina-1 (IL-1), tal como es el canakinumab aumenta el posible riesgo de reactivación de la tuberculosis o de otro tipo de infecciones oportunistas. Es recomendable que se realice un examen exhaustivo antes de comenzar un tratamiento con el canakinumab. (Ver artículo cetrorelix)
El canakinumab puede llegar a producir neutropenia (conteo bajo anormal del tipo de glóbulos blancos llamados neutrófilos), y por lo que no se debe comenzar una terapia con este medicamento en los pacientes que tienen neutropenia.
Es recomendable controlar el conteo de los neutrófilos antes de comenzar la terapia y nuevamente, posteriormente de uno (1) o dos (2) meses. Si un paciente presenta neutropenia, deberá ser controlado de manera estrecha el conteo de los neutrófilos y podría considerarse la suspensión del tratamiento.
Embarazo
El canakinumab se encuentra clasificado dentro de la categoría C de posible riesgo en el embarazo. Se tienen datos muy limitados sobre el uso del canakinumab en las pacientes embarazadas. Los ensayos realizados en animales no presentan efectos dañinos de manera directa o indirecta por lo que corresponde a la toxicidad a nivel reproductivo.
No se conoce el posible riesgo para el feto y/o la madre. Las mujeres deben usar algún tipo de método anticonceptivo efectivo mientras dure la terapia con el canakinumab y hasta por lo menos tres (3) meses después de consumida la última dosis. Las mujeres que se encuentran embarazadas o que deseen quedar embarazadas, solamente deberían realizar el tratamiento después de realizar un exhaustivo análisis de los beneficios versus los riesgos.
Lactancia
Hasta el momento no se conoce si el canakinumab es excretado a través de la leche materna. La decisión de si se debe lactar durante la terapia con el canakinumab, solamente se debe tomar después de realizar un análisis completo de los beneficios y de los riesgos.
Los ensayos realizados en animales han mostrado que un anticuerpo murino que tiene efecto sobre la IL-1 beta murina, no presentó efectos adversos sobre el crecimiento de las crías de ratón y a los que el anticuerpo les fue traspasado.
Interacciones
No se han realizado investigaciones sobre las posibles interacciones entre el canakinumab y otros fármacos con estudios de tipo formal.
Se ha presentado una incidencia incrementada de infecciones graves con otro bloqueante de la IL-1 en conjunto con cohibidores del TNF. No es recomendable el uso de el canakinumab con cohibidores del TNF, ya que esto puede llegar a incrementar el posible riesgo de infecciones graves.
La expresión de las enzimas hepáticas CYP450 puede llegar a ser anulada por las citocinas, que se encargan de estimular la inflamación crónica, tal como es la interleucina-1 beta (IL-1 beta). De esta manera, la expresión de CYP450 se puede llegar a revertir cuando se introduce una terapia con un cohibidor potente de la citocina, como es el canakinumab.
Esto es clínicamente destacado para los sustratos del CYP450, que tienen un estrecho margen terapéutico para los que se deben ajustar las dosis de forma individual. Al comenzar la terapia con el canakinumab en los pacientes que reciben esta clase de fármacos, es necesario vigilar el efecto o la cantidad del principio activo y realizar un ajuste a la dosis de forma individual si fuese necesario.
Hasta el momento no se tienen datos sobre los posibles efectos de la aplicación de vacunas vivas o la transmisión de la infección secundaria a la aplicación de una vacuna viva, en los pacientes que están recibiendo el canakinumab. Por todo esto, no se deben administrar vacunas vivas en conjunto con el canakinumab a menos que los beneficios sean más que los riesgos.
Toxicidad
El canakinumbab se une a la IL-1 beta de los seres humanos y de los monos babuinos (C. jacchus) con una afinidad muy parecida y, por lo tanto, la toxicidad ha sido estudiada en estos animales. No se han presentado efectos adversos de el canakinumab posteriormente a la aplicación dos (2) veces por semana por un periodo de veintiséis (26) semanas a los monos babuinos.
Tampoco se presentaron síntomas de toxicidad en el ensayo del crecimiento embriofetal realizado en las monas embarazadas. Las cantidades plasmáticas que son bien toleradas en estos animales, sobrepasan como mínimo cuarenta y dos (42) veces (Cmax) y setenta y ocho (78) veces (Cmax) las cantidades plasmáticas en los pacientes de tipo pediátrico que presentan síndromes periódicos ligados a la criorpirina, que son tratados con dosis de canakinumab de hasta 8 mg/kg por la vía subcutánea aplicadas cada ocho (8) semanas.
Además, no se presentaron anticuerpos frente a el canakinumab en estos ensayos. No se logró demostrar que exista algún tipo de reactividad cruzada inespecífica cuando se administró el canakinumab a los tejidos humanos sanos.
Este artículo es netamente informativo, en ningún momento se intenta sustituir la opinión médica, por eso siempre se debe consultar con el médico especialista antes de iniciar cualquier tratamiento con medicamentos.
Actualizado el 16 enero, 2020